Identifica la distancia que existe entre el núcleo y el orbital más externo de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
- En los periodos, el radio atómico aumenta de derecha a izquierda, ya que al ir hacia la derecha, el número atómico (Z) aumenta en una unidad al pasar de un elemento a otro, es decir, hay un aumento de carga nuclear por lo que los electrones son atraídos más fuertemente hacia el núcleo disminuyendo así el radio atómico.
- El radio atómico puede ser covalente o metálico. La distancia entre núcleos de átomos "vecinos" en una molécula es la suma de sus radios covalentes, mientras que el radio metálico es la mitad de la distancia entre núcleos de átomos "vecinos" en cristales metálicos. Usualmente, por radio atómico se ha de entender radio covalente.
Radios iónicos:

El radio iónico es, al igual que el radio atómico, la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo, pero haciendo referencia no al átomo, sino al ion. Éste aumenta en la tabla de derecha a izquierda por los períodos y de arriba hacia abajo en los grupos.

En el caso de los cationes, la ausencia de uno o varios electrones disminuye la fuerza eléctrica de repulsión mutua entre los electrones restantes, provocando el acercamiento de los mismos entre sí y al núcleo positivo del átomo, del que resulta un radio iónico menor que el atómico.
En el caso de los aniones, el fenómeno es el contrario, el exceso de carga electrónica negativa obliga a los electrones a alejarse unos de otros para restablecer el equilibrio de fuerzas eléctricas, de modo que el radio iónico es mayor que el atómico.
4.2 Energía de ionización
Es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental para
arrancarle el electrón mas externo, que esta mas débilmente retenido, y convertirlo en un cateon monopositivo gaseoso.
arrancarle el electrón mas externo, que esta mas débilmente retenido, y convertirlo en un cateon monopositivo gaseoso.
La magnitud de la energía de ionización depende de tres factores fundamentales: estructura electrónica de la ultima capa, radio atómico y carga nuclear. El factor determinante es la configuración electrónica de la ultima capa, puesto que cuanto mas estable sea, es decir cuanto mas se parezca a la de estructura completa, estructura de gas noble, mayor energía sera necesaria para arrancar un electrón.
 Dado que se trata de energía liberada, pues normalmente al insertar un electrón en un átomo predomina la fuerza atractiva del núcleo, tiene signo negativo. En los casos en los que la energía sea absorbida, cuando ganan las fuerzas de repulsión, tendrán signo positivo.
Dado que se trata de energía liberada, pues normalmente al insertar un electrón en un átomo predomina la fuerza atractiva del núcleo, tiene signo negativo. En los casos en los que la energía sea absorbida, cuando ganan las fuerzas de repulsión, tendrán signo positivo.
 La
electronegatividad (EN) mide la mayor o menor
atracción- y, por lo tanto, desplazamiento- que un átomo ejerce sobre el par de
electrones de un enlace con otro átomo.
Su valor se determina a partir de una escala. La más utilizada es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7. Esta es la propiedad relevante
La
electronegatividad (EN) mide la mayor o menor
atracción- y, por lo tanto, desplazamiento- que un átomo ejerce sobre el par de
electrones de un enlace con otro átomo.
Su valor se determina a partir de una escala. La más utilizada es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7. Esta es la propiedad relevante
en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.
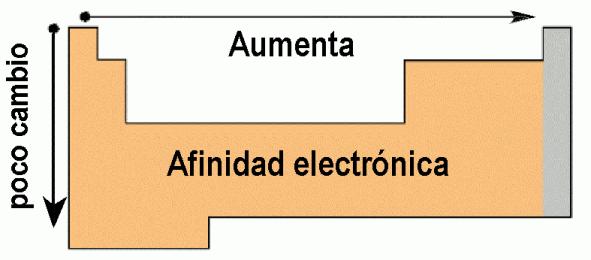
4.3 Afinidad electrónica
La afinidad electrónica o electroafinidad se define como la energía liberada cuando un átomo gaseoso neutro en su estado fundamental (en su menor nivel de energía) captura un electrón y forma un ion mononegativo.
También podemos recurrir al proceso contrario para determinar la primera afinidad electrónica, ya que sería la energía consumida en arrancar un electrón a la especie aniónica mononegativa en estado gaseoso de un determinado elemento.
Este proceso equivale al de la energía de ionización de un átomo, por lo que sería la energía de ionización de orden cero.
Esta propiedad nos sirve para prever qué elementos generarán con facilidad especies aniónicas estables, aunque no hay que relegar otros factores: tipo de contraión, estado sólido, ligando-disolución, etc.
4.4 Electronegatividad y carácter metálico
La electronegatividad es un concepto
químico más que una propiedad de los elementos aunque, por supuesto, el valor
de dicha magnitud depende de su comportamiento químico.
 La
electronegatividad (EN) mide la mayor o menor
atracción- y, por lo tanto, desplazamiento- que un átomo ejerce sobre el par de
electrones de un enlace con otro átomo.
La
electronegatividad (EN) mide la mayor o menor
atracción- y, por lo tanto, desplazamiento- que un átomo ejerce sobre el par de
electrones de un enlace con otro átomo.en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.


Excelente clara y concisa explicación, gracias por compartirla.
ResponderBorrar